Ce este cardiomiopatia hipertrofică?
Cardiomiopatia hipertrofică (CMH) este o afecțiune cu transmitere genetică ce constă în îngroșarea anormală a pereților inimii, în lipsa unei alte patologii care ar putea determina hipertrofia acestora.
Această îngroșare inadecvată a pereților cardiaci determină modificări mecanice, dar și electrice la nivelul inimii, care stau la baza simptomatologiei acestei patologii. De această boală suferă aproximativ 1 din 500 de oameni din întreaga lume, sunt afectați în egală masură bărbații și femeile, iar cele mai multe persoane cu CMH au o calitate bună a vieții și o speranță de viață normală.
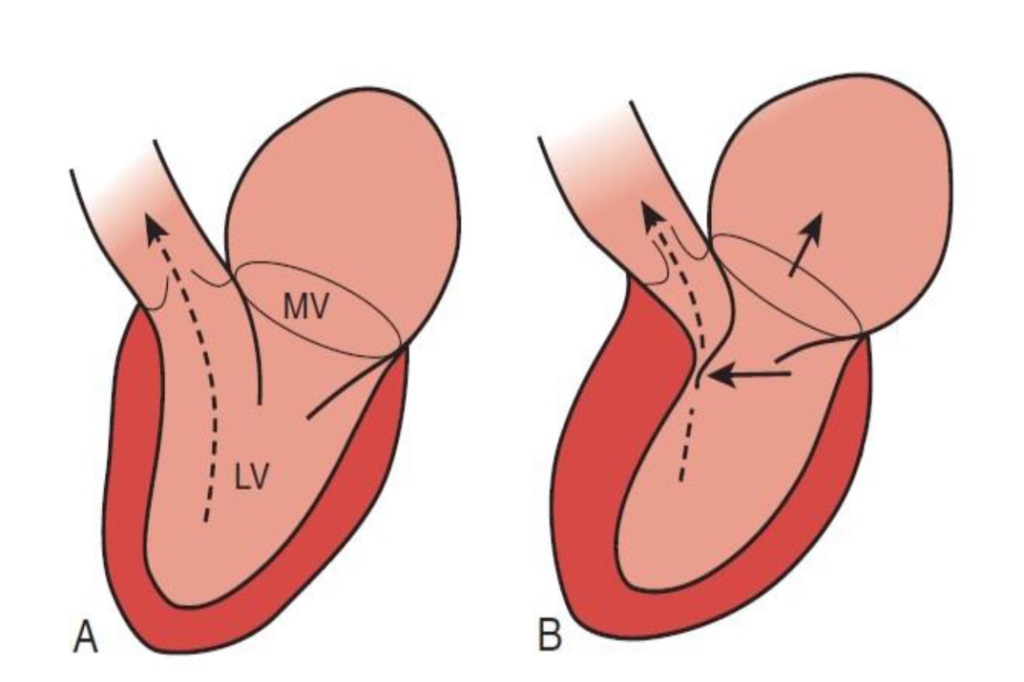
Dintre pacienții cu CMH, o proporție importantă (aproximativ o treime) dezvoltă forma sa obstructivă, denumită cardiomiopatie hipertrofică obstructivă (CMHO). Aceasta se datorează faptului că în calea de ieșire a ventriculului stâng (pompa inimii) apare un obstacol (prin hipertrofia inadecvata a peretelui ventricular) care determină o muncă suplimentară a inimii. Acestă obstrucție este însoțită și de o închidere anomală a valvei mitrale care face să scadă suplimentar eficiența pompei cardiace.
Care sunt simptomele acestei boli?
Multe persoane cu CMH sunt descoperite întâmplător la un examen medical de rutină – un ECG anormal, sau un suflu cardiac decelat la examenul clinic. Alți pacienți se prezintă la medic cu simptome precum sufocare la efort, durere toracică, palpitații, amețeli sau după ce își pierd starea de conștiență (sincopă). Există însă și situații cu simptome severe de insuficiență cardiacă sau chiar moarte subită.
Evaluarea completă a unui pacient cu CMH cuprinde: electrocardiograma, ecocardiografia transtoracică de repaus și/sau de stress, eventual ecocardiografia transesofagiana, monitorizare Holter ECG/24 sau 48 de ore, rezonanță magnetică cardiacă și testarea genetică. De asemenea, trebuie știut că în cazul bolilor genetice trebuie investigate și rudele de sânge.
Cum se tratează cardiomiopatia hipertrofică?
Tratamentul CMH poate fi împărțit în 3 categorii – modificări ale stilului de viață, măsuri care țin de siguranța pacientului și tratamentul simptomatic.
În ceea ce privește stilul de viață, nu există schimbări specifice ale acestuia, sau o dietă anume care să modifice istoria naturală a bolii. Totuși, câteva precauții suplimentare există. La acești pacienți se contraindică sportul de performanță, CMH fiind cea mai frecventă cauză de moarte subită la sportivi. Acest lucru nu înseamnă că aceștia nu trebuie să fie activi, ci să nu se implice în activități fizice intense sau extreme. Trebuie evitat efortul izometric (ridicatul de greutăți) și este încurajat efortul de tip cardio de intensitate moderată, cu inițierea și întreruperea progresivă a activității fizice. În ceea ce priveste alimentația, trebuie subliniată importanța hidratării corecte, știut fiind faptul că în condiții de deshidratare, obstrucția se agravează, a menținerii echilibrului electroliților al căror dezechilibru favorizează apariția aritmiilor și a unei diete echilibrate, deoarece mesele copioase pot exacerba simptomatologia.
Evitarea alcoolului, a băuturilor energizante, cafelei, ceaiului verde și negru este de asemenea recomandată, aceastea favorizând apariția palpitațiilor.
În ceea ce privește siguranța pacientului, în această boală există posibilitatea apariției unui eveniment numit moarte subită cardiacă, care cel mai adesea se produce secundar aritmiilor. Acestea sunt cauzate de dezorganizarea de la nivel celular și de prezența fibrozei, aspecte microscopice specifice acestei patologii, și sunt favorizate de orice factor care determină un dezechilibru la nivelul inimii. În timp ce acest risc este mai mare la pacienții cu CMH decât în populația generală, el este doar de 1% pe an.
Fiecare pacient trebuie evaluat pentru a determina dacă acesta se află în grupul de risc înalt, in acest caz beneficiind de un dispozitiv numit defibrilator implantabil (ICD-Implantable Cardioverter Defibrilator).
Aceasta presupune evaluarea unui număr de factori de risc pe care un pacient și familia sa îi pot prezenta și astfel putem aprecia daca un ICD poate fi benefic pentru el. Nu în ultimul rând, familiile pacienților cu CMH ar trebui instruite în acodarea primului ajutor și a tenhicilor de resuscitare cardio-pulmonară.
Pentru tratamentul simptomelor, dispnee sau durerea toracică, pacienții primesc frecvent terapie medicamentoasă sub care acestea pot să se amelioreze, sau chiar să dispară. Există medicamente ce agravează simptomele legate de CMH și medicamente eficiente în tratamentul simptomelor. Totuși, există pacienți ce rămân simptomatici în ciuda tratamentului medicamentos maximal, sau suferă de pe urma reacțiilor adverse ale acestuia, iar pentru aceștia există terapii invazive care includ tehnici de chirurgie cardiacă sau cardiologie intervențională.
La momentul actual, cea mai eficientă terapie invazivă este reprezentată de o intervenție de chirurgie cardiacă numită miectomie septală, intervenție prin care se eliberează tractul de ejecție al ventriculului stâng, cu o rată de succes de aproximativ 95% și o rată de apariție a complicațiilor extrem de scăzută (sub 1%) atunci când este realizată în centre specializate, de către chirurgi cu experiență. Miectomia presupune rezecția musculară extinsă, strict calculată și realizată individual pentru fiecare pacient în parte, de la nivelul septului interventricular pentru a lărgi suficient tractul de ejecție al ventriculului stâng, asociat cu rezecția cordajelor secundare mitrale pentru a reduce astfel mișcarea anormala a valvei mitrale. Dificilă tehnic, ea se poate realiza numai după acumularea unei lungi experiențe și se bazează pe datele obținute de ecocardiografie și rezonanță magnetică cardiacă. Beneficiile pentru pacienţii care apelează la această tehnică sunt ameliorarea simptomatologiei și scăderea importantă a riscului de moarte subită, rezultate stabile pe termen lung, pacientul revenind la o viaţă cvasinormală.
Ca o alternativă, unii pacienți pot beneficia de o intervenție numită ablație septală cu alcool. Aceasta încearcă să realizeze același lucru ca și miectomia, însă, spre deosebire de intervenția chirurgicală, depinde de anatomia coronariană, și nu beneficiază de intervenția asupra aparatului valvular mitral.
Astfel, rata de succes este mai mică (aproximativ 75%), iar numărul complicațiilor este mai mare, ceea ce nu contrabalansează disconfortul creat de intervenția chirurgicală. În ultimii ani, a scăzut entuziasmul pentru ablația septală și din cauza potențialului său aritmogen și a eliminării incomplete a obstrucției.
Screeningul familial în cardiomiopatia hipertrofică
Deoarece cardiomiopatia hipertrofică este o boală genetică, fiecare dintre copiii pacienților cu această afecțiune prezintă un risc de moștenire de 50%. Astfel, se recomandă screeningul familial al pacienților cu CMH, care poate fi realizat fie prin testare genetică, fie prin efectuarea de ecocardiografii repetate. Pentru screeningul genetic, testăm inițial probe de sânge de la pacient pentru a vedea dacă putem identifica secvența codului genetic responsabilă de apariția bolii. Dacă găsim această secvență, putem testa apoi familia pacientului pentru a căuta aceeași secvență. Dacă testarea genetică nu este disponibilă sau dacă pacientul nu este de acord cu aceasta, atunci screeningul se bazează pe ecocardiografie. Recomandăm evaluare ecocardiografică periodică la toate rudele de gradul I sau la oricare rudă a unui pacient diagnosticat cu CMH care practică sportul de performanță. Adolescenții și sportivii trebuie evaluați anual, în timp ce adulții trebuie evaluați la 5 ani.